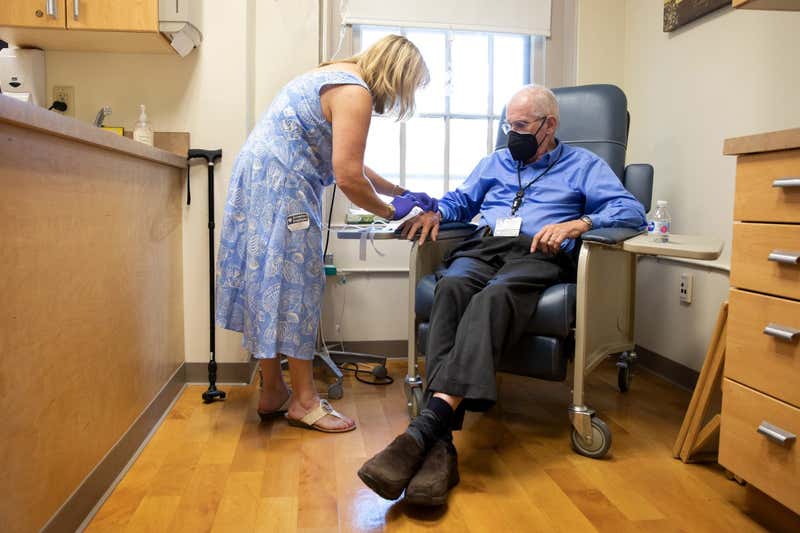
Αναμένουμε να δούμε τη συζήτηση για ένα νέο φάρμακο για τη θεραπεία της νόσου του Αλτσχάιμερ, που ονομάζεται aducanumab, να συνεχιστεί το 2022 .
Εγκρίθηκε στις ΗΠΑ τον περασμένο Ιούνιο, είναι το πρώτο φάρμακο που σχεδιάστηκε για τη θεραπεία μιας πιθανής αιτίας αυτής της μορφής άνοιας και όχι των συμπτωμάτων.
Το aducanumab στοχεύει το βήτα-αμυλοειδές, μια πρωτεΐνη που σχηματίζει πλάκες στον εγκέφαλο που παρατηρούνται συχνά σε άτομα με νόσο του Αλτσχάιμερ.
Αλλά το φάρμακο έχει τους επικριτές του καθώς και τους μαζορέτες του.
Μέχρι στιγμής δεν έχει αποδειχθεί ότι μειώνει την απώλεια μνήμης και τη σύγχυση, τα κύρια συμπτώματα της νόσου του Αλτσχάιμερ.
Άλλα φάρμακα που χρησιμοποιούνται, συνήθως ανακουφίζουν ελαφρώς αυτά τα συμπτώματα, αλλά δεν λειτουργούν σε όλους και τα αποτελέσματά τους εξαφανίζονται.
Ο ρυθμιστικός φορέας φαρμάκων των ΗΠΑ, ο Οργανισμός Τροφίμων και Φαρμάκων (FDA), ενέκρινε το aducanumab για χρήση για την καταπολέμηση της πρώιμης νόσου Αλτσχάιμερ με βάση ότι μειώνει την έκταση των αμυλοειδών πλακών .
Αυτά θεωρούνται εδώ και καιρό ως «βιοδείκτης» της νόσου του Αλτσχάιμερ – με άλλα λόγια, ένας βιολογικός δείκτης της εξέλιξης ή της σοβαρότητας της νόσου.
Άλλα φάρμακα έχουν εγκριθεί με βάση βιοδείκτες – για παράδειγμα, τα επίπεδα της «κακής χοληστερόλης» θεωρούνται βιοδείκτης για καρδιακές παθήσεις .
Αλλά για τη νόσο του Αλτσχάιμερ, εξακολουθεί να συζητείται εάν οι πλάκες είναι έγκυρος βιοδείκτης.
Υπάρχει αυξανόμενη ανησυχία ότι μπορεί να μην είναι αιτία, αλλά κάτι περισσότερο σαν παρενέργεια της διαδικασίας της νόσου .
Η στόχευση των πλακών είναι «εύλογα πιθανό να έχει κλινικό αποτέλεσμα», λέει η Susan Kohlhaas στο Alzheimer’s Research UK.
«Αλλά αυτό πρέπει ακόμα να δοκιμαστεί», προσθέτει.
Όταν ο FDA ενέκρινε το aducanumab, πήγε ενάντια στις συστάσεις της επιστημονικής συμβουλευτικής επιτροπής του, τις οποίες συνήθως ακολουθεί – κανένα από τα 11 μέλη δεν το θεώρησε έτοιμο για έγκριση και τρία μέλη παραιτήθηκαν σε ένδειξη διαμαρτυρίας.
Ο αναπληρωτής επίτροπος της υπηρεσίας ζήτησε από τότε να διεξαχθεί έρευνα για τη διαδικασία έγκρισης.
Δεν πρέπει να αφήσουμε κανένα βήμα πάνω στην αναζήτησή μας για θεραπείες».
Μια κλινική δοκιμή έδειξε ότι περίπου το 40% των ατόμων που λάμβαναν το φάρμακο παρουσίασαν οίδημα ή αιμορραγία στον εγκέφαλο, ορατό σε μια σάρωση.
Ο FDA είπε ότι το aducanumab θα πρέπει τώρα να δοκιμαστεί σε μια μεγαλύτερη κλινική δοκιμή, αλλά στην πράξη μπορεί να χρειαστούν πολλά χρόνια για να παραχθούν αποτελέσματα.
Λίγοι άνθρωποι μπορεί να θέλουν να συμμετέχουν σε μια ελεγχόμενη με εικονικό φάρμακο δοκιμή και να κινδυνεύουν να πάρουν ψευδή χάπια μετά την έγκριση του φαρμάκου.
Στις 17 Δεκεμβρίου, ο Ευρωπαϊκός Οργανισμός Φαρμάκων αποφάσισε να μην εγκρίνει το aducanumab.
Είναι επίσης υπό εξέταση από τον Ρυθμιστικό Οργανισμό Φαρμάκων και Προϊόντων Υγείας του Ηνωμένου Βασιλείου.
Εάν το φάρμακο εγκριθεί στο Ηνωμένο Βασίλειο, θα πρέπει να αξιολογηθεί για να αποφασιστεί εάν είναι οικονομικά αποδοτικό για χρήση από τις εθνικές υπηρεσίες υγείας.
Στις ΗΠΑ κοστολογείται στα 56.000 δολάρια το χρόνο.
«Πρέπει να βεβαιωθούμε ότι δεν αφήνουμε κανένα βήμα πάνω στην αναζήτησή μας για θεραπείες που αλλάζουν τη ζωή», λέει ο Kohlhaas.
«Είναι σημαντικό να σεβόμαστε τη ρυθμιστική διαδικασία που συμβαίνει στο Ηνωμένο Βασίλειο και αλλού.
Πρέπει επίσης να βεβαιωθούμε ότι οι θεραπείες μας αξιολογούνται ως προς την ασφάλεια και την αποτελεσματικότητα», πρόσθεσε.
Σύνδεσμος για το άρθρο: https://www.newscientist.com/article/mg25233661-400-2022-preview-expect-a-row-over-controversial-alzheimers-drug/