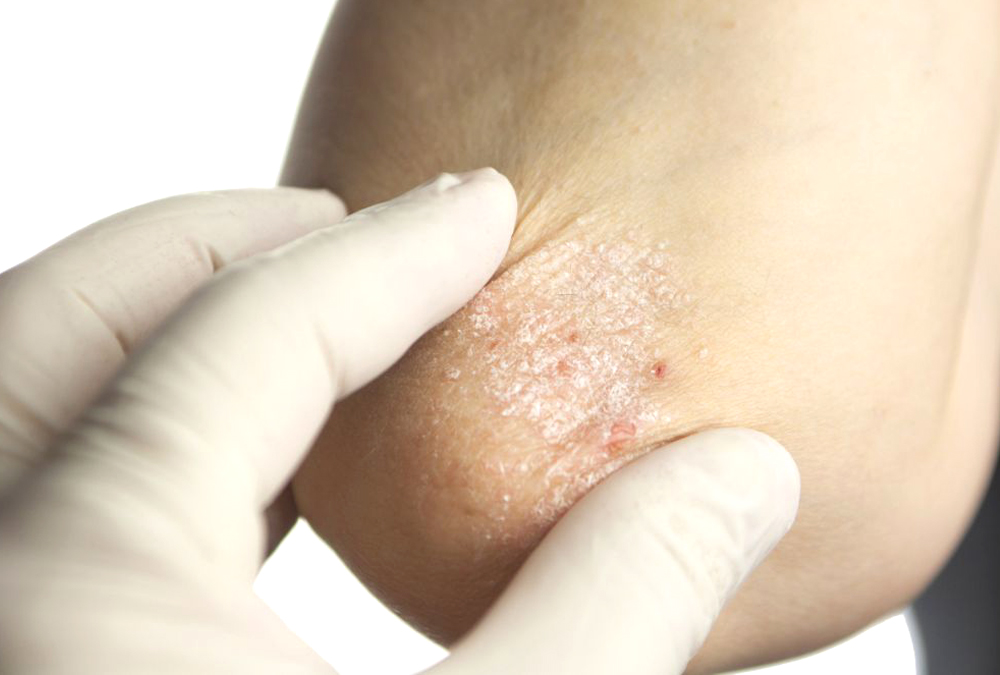
Τα πλήρη αποτελέσματα από τις μελέτες BE RADIANT και BE SURE, που συνέκριναν την ασφάλεια και αποτελεσματικότητα του bimekizumab με το secukinumab και το adalimumab αντίστοιχα, δημοσιεύθηκαν σήμερα σε δύο άρθρα.
Τα αποτελέσματα της BE RADIANT μοιράστηκαν επίσης σήμερα ως προφορικές παρουσιάσεις στο AAD VMX 2021.
Στην BE RADIANT, το bimekizumab ήταν ανώτερο του secukinumab στην επίτευξη πλήρως καθαρού δέρματος (PASI 100) τη 16η εβδομάδα, κύριο καταληκτικό στοιχείο της μελέτης, και τη 48 η εβδομάδα, δευτερεύον καταληκτικό σημείο
Το Bimekizumab είναι υπό αξιολόγηση από τον Αμερικανικό Οργανισμό Τροφίμων και Φαρμάκων (FDA) και τον Ευρωπαϊκό Οργανισμό Φαρμάκων (EMA) για τη θεραπεία ενήλικων ασθενών με μέτρια ως σοβαρή Ψωρίαση κατά πλάκας.
Η βιοφαρμακευτική εταιρεία UCB, με παρουσία σε όλο τον κόσμο ανακοίνωσε ότι το The New England Journal of Medicine δημοσίευσε τα αποτελέσματα των BE RADIANT και BE SURE, 2 μελετών φάσης 3 που αξιολόγησαν το προφίλ ασφάλειας και αποτελεσματικότητας του bimekizumab, ενός υπό έρευνα αναστολέα IL-17A και IL-17F, στη θεραπεία ασθενών με μέτρια ως σοβαρή Ψωρίαση κατά Πλάκας.
Τα αποτελέσματα της μελέτης φάσης 3β BE RADIANT ανακοινώθηκαν σήμερα προφορικά στο American Academy of Dermatology Virtual meeting Experience 2021.
H BE RADIANT είναι η πρώτη μελέτη φάσης 3 που συνέκρινε την αποτελεσματικότητα και την ασφάλεια της διπλής αναστολής των IL-17A και IL-17F, έναντι της αναστολής της IL-17A μόνο.
“Η δημοσίευση των δεδομένων από τις μελέτες BE RADIANT και BE SURE
στο The New England Journal of Medicine υπογραμμίζει τη σημασία των
μελετών αυτών για την ιατρική κοινότητα και ακολουθεί τη δημοσίευση τους
στοThe Lancet”, είπε ο Emmanuel Caeymaex, Εκτελεστικός Αντιπρόεδρος
Ανοσολογίας και επικεφαλής UCB, ΗΠΑ.
“Τα αποτελέσματα που ανακοινώθηκαν σήμερα, αντικατοπτρίζουν τα υψηλά
ποσοστά πλήρους κάθαρσης του δέρματος, PASI 100 τη 16 η εβδομάδα, την
ταχεία απόκριση μετά από μία δόση και τη διατηρησιμότητα των
αποτελεσμάτων έως και ένα χρόνο, τα οποία είχαν παρατηρηθεί και στις
προηγούμενες μελέτες του bimekizumab”, πρόσθεσε.
Η ασφάλεια και η αποτελεσματικότητα του bimekizumab δεν έχουν
τεκμηριωθεί και δεν έχει εγκριθεί από καμία ρυθμιστική αρχή παγκοσμίως.
Αποτελέσματα BE RADIANT
Η μελέτη φάσης 3β BE RADIANT, συνέκρινε την ασφάλεια και αποτελεσματικότητα της μπιμεκιζουμάμπης σε σχέση με τη σεκουκινουμάμπη, σε ενήλικες ασθενείς με μέτρια ως σοβαρή Ψωρίαση κατά πλάκας.
Η μελέτη πέτυχε το κύριο καταληκτικό της σημείο, με σημαντικά περισσότερους ασθενείς που έλαβαν μπιμεκιζουμάμπη, να επιτυγχάνουν πλήρη κάθαρση δέρματος, όπως αυτή μετρήθηκε με τον Δείκτη Έκτασης και Βαρύτητας της Ψωρίασης (PASI 100) τη 16η εβδομάδα σε σύγκριση με τους ασθενείς που έλαβαν σεκουκινουμάμπη (61,7% έναντι 48,9% αντιστοίχως, p<0,001).
Η μελέτη πέτυχε επίσης όλα τα δευτερεύοντα καταληκτικά της σημεία.
Τα ανώτερα επίπεδα επίτευξης καθαρού δέρματος που παρατηρήθηκαν τη 16η
εβδομάδα, συνεχίστηκαν μέχρι την εβδομάδα 48, με το 67.0% των ασθενών
πού έλαβαν bimekizumab να επιτυγχάνουν PASI 100, συγκριτικά με το 46,02% των ασθενών που έλαβαν secukinumab (p<0.001).
Tην 48 η εβδομάδα, τόσο οι ασθενείς που έλαβαν bimekizumab κάθε 4 εβδομάδες
(Q4W), όσο και αυτοί που το έλαβαν κάθε 8 εβδομάδες (Q8W), επέδειξαν
υψηλότερα ποσοστά πλήρους κάθαρσης του δέρματος (PASI 100),
συγκριτικά με το secukinumab (p<0.001).
Επιπρόσθετα, την 4 η εβδομάδα, σημαντικά περισσότεροι ασθενείς που έλαβαν bimekizumab πέτυχαν PASI 75 συγκριτικά με τους ασθενείς που έλαβαν secukinumab (71.0% έναντι 47.3%, αντίστοιχα; p<0.001).
“Στην BE RADIANT, ασθενείς που έλαβαν bimekizumab πέτυχαν ανώτερα
ποσοστά πλήρους κάθαρσης του δέρματος, το κύριο καταληκτικό σημείο της
μελέτης, τα οποία διατηρήθηκαν μέχρι και τη 48 η εβδομάδα.
Την 4 η εβδομάδα, παρατηρήθηκε επίσης γρηγορότερη έναρξη δράσης στους ασθενείς που έλαβαν bimekizumab συγκριτικά με αυτούς που έλαβαν secukinumab. Τα δεδομένα της μελέτης υποστηρίζουν την αξία της αναστολής της IL-17F
επιπρόσθετα με την IL17A στη θεραπεία των ασθενών με μέτρια ως σοβαρή
Ψωρίαση κατά Πλάκας”, είπε ο Κ. Kristian Reich, M.D., Ph.D., Translational
Research in Inflammatory Skin Diseases, Institute for Health Services
Research in Dermatology and Nursing, University Medical Center Hamburg-
Eppendorf, Germany.
Καθ’ όλη τη διάρκεια της μελέτης, το πιο κοινό ανεπιθύμητο σύμβαμα που
προέκυψε από τη θεραπεία (TEAEs) με bimekizumab ήταν:
-η λοίμωξη ανώτερου αναπνευστικού* (38.9%),
-στοματική λοίμωξη από candida (19.3%),και,
-λοιμώξεις ουροποιητικού (6.7%).
Τα περιστατικά στοματικής καντιντίασης ήταν κυρίως ήπιας ή μέτριας βαρύτητας και κανένα δεν οδήγησε σε διακοπή της θεραπείας.
Σε διάστημα 48 εβδομάδων η επίπτωση των σχετιζόμενων με τη θεραπεία ανεπιθύμητων συμβάντων ήταν:
-5,9% για το bimekizumab και,
-5,7% με το secukinumab .
Αποτελέσματα BE SURE
Η μελέτη Φάσης 3 BE SURE συνέκρινε την αποτελεσματικότητα και ασφάλεια του bimekizumab συγκριτικά με το adalimumab σε ενήλικες ασθενείς με μέτρια ως σοβαρή Ψωρίαση κατά πλάκας.
Τα αποτελέσματα της μελέτης BE SURE είχαν προηγουμένως αναφερθεί στο Συνέδριο 2020 της Ευρωπαϊκής Ακαδημίας Δερματολογίας και Αφροδισιολογίας (EADV).
Η BE SURE πέτυχε τα κύρια καταληκτικά σημεία της, αποδεικνύοντας ότι οι
ασθενείς που έλαβαν bimekizumab πέτυχαν ανώτερα επίπεδα κάθαρσης του
δέρματος, την 16η εβδομάδα, σε σύγκριση με εκείνους που έλαβαν adalimumab, όπως μετρήθηκε από την επίτευξη του PASI 90 και την ανταπόκριση για «καθαρό», ή «σχεδόν καθαρό» δέρμα (IGA 0/1); p <0,001 και για τις δύο συγκρίσεις.
Τα αποτελέσματα αυτά υποστηρίχθηκαν περεταίρω, καθώς η μελέτη πέτυχε και όλα τα δευτερεύοντα καταληκτικά της σημεία.
Το προφίλ ασφάλειας του bimekizumab ήταν συνεπές με τα αποτελέσματα των
προηγούμενων κλινικών μελετών και δεν εντοπίστηκαν νέα σήματα
ασφάλειας.
Τον Σεπτέμβριο του 2020, η UCB ανακοίνωσε ότι ο FDA και ο EMA είχαν
αποδεχτεί την Αίτηση Βιολογικής Άδειας της Εταιρείας (BLA) και την Αίτηση
Άδειας Κυκλοφορίας (MAA), αντίστοιχα, για το bimekizumab για τη θεραπεία
της μέτριας έως σοβαρής Ψωρίασης κατά Πλάκας σε ενήλικες ασθενείς.
Η UCB αποσκοπεί να παρέχει πρόσβαση στο bimekizumab σε ασθενείς σε όλο
τον κόσμο, και για αυτόν τον σκοπό έχουν υποβληθεί επιπρόσθετες αιτήσεις
έγκρισης που βρίσκονται σε εξέλιξη.
*Οι λοιμώξεις του ανώτερου αναπνευστικού συστήματος περιλαμβάνουν
λαρυγγίτιδα, ρινοφαρυγγίτιδα, φαρυγγικό απόστημα, φαρυγγίτιδα, ρινίτιδα,
ιγμορίτιδα, αμυγδαλίτιδα και λοίμωξη του ανώτερου αναπνευστικού
συστήματος.