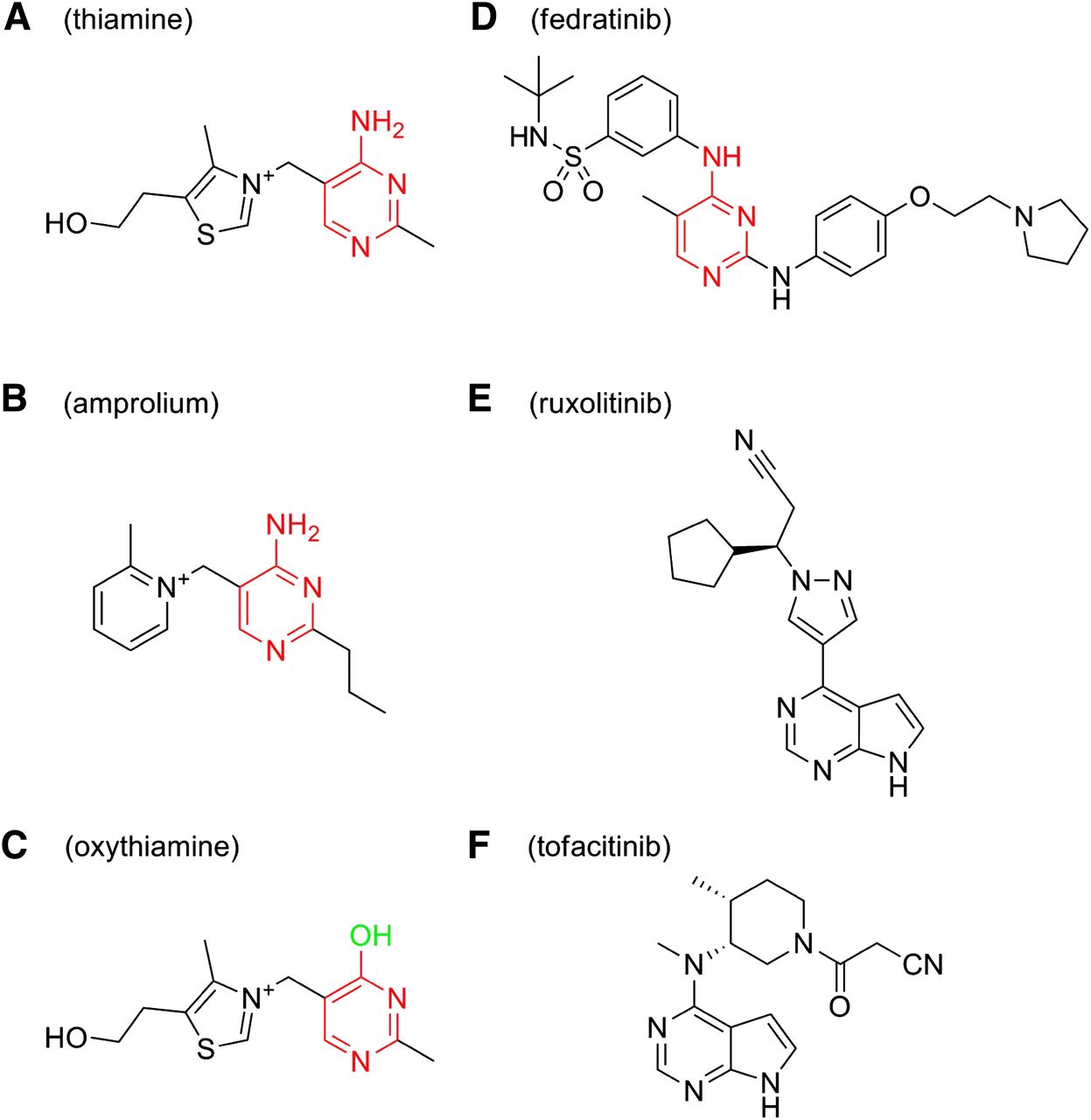
Η Bristo lMyers Squibb (NYSE: BMY) ανακοίνωσε πρόσφατα ότι η Ευρωπαϊκή Επιτροπή χορήγησε πλήρη άδεια κυκλοφορίας για το fedratinib για τη θεραπεία της σχετιζόμενης με τη νόσο σπληνομεγαλίας (διογκωμένος σπλήνας) ή συμπτωμάτων σε ενήλικες ασθενείς με πρωτοπαθή μυελοΐνωση, μυελοΐνωση κατόπιν αληθούς πολυκυτταραιμίας ή μυελοΐνωση κατόπιν ιδιοπαθούς θρομβοκυττάρωσης, οι οποίοι δεν έχουν λάβει προηγούμενη θεραπεία με αναστολέα των κινασών Janus(JAK) ή έχουν λάβει θεραπεία με ruxolitinib.
Το fedratinib αποτελεί την πρώτη από του στόματος άπαξ ημερησίως χορηγούμενη θεραπεία για τη σημαντική μείωση του μεγέθους του σπλήνα και την άμβλυνση των συμπτωμάτων σε ασθενείς μεμυελοΐνωση οι οποίοι είτε έχουν αποτύχει σε θεραπεία μεruxolitinib, είτε παρουσιάζουν δυσανεξία στο ruxolitinib ή δεν έχουν λάβει προηγούμενη θεραπεία με αναστολέα JAK.
Η κεντρική Άδεια Κυκλοφορίας εγκρίνει τη χρήση τουfedratinibσε όλα τα κράτη μέλη της Ευρωπαϊκής Ένωσης, καθώς και στη Νορβηγία, στην Ισλανδία και στο Λιχτενστάιν.
Το fedratinib έλαβε τον χαρακτηρισμό του ορφανού φαρμάκου στις Ηνωμένες Πολιτείες και έχει επίσης εγκριθεί στις Ηνωμένες Πολιτείες και στον Καναδά.
Η νόσος μυελοΐνωση
«Η μυελοΐνωση αποτελεί μια σοβαρή και συχνά εξουθενωτική διαταραχή του μυελού των οστών για την οποία υπήρχε μόνο μία εγκεκριμένη θεραπευτική επιλογή εδώ και σχεδόν μία δεκαετία», δήλωσε η Claire Harrison, M.D., FRCP, FRC Path, κύρια ερευνήτρια των μελετών JAKARTA και JAKARTA2 και καθηγήτρια Αιματολογίας στο νοσηλευτικό ίδρυμα Guy’sandSt. Thomas’του Βρετανικού Εθνικού Συστήματος Υγείας στο Λονδίνο.
«Το fedratinib κατέδειξε κλινικώς σημαντική μείωση του όγκου του σπλήνα και των συμπτωμάτων σε ασθενείς που παρουσίασαν εξέλιξη της νόσου ενώ λάμβαναν ruxolitinibή σε ασθενείς οι οποίοι δεν έχουν λάβει προηγούμενη θεραπεία με αναστολέα J AK.
Σχεδόν ένας στους 100.000 ανθρώπους στην Ευρωπαϊκή Ένωση θα διαγιγνώσκεται με μυελοΐνωση κάθε χρόνο και η σημερινή έγκριση προσφέρει μια σημαντική νέα επιλογή για τους ασθενείς που συνεχίζουν να χρειάζονται επειγόντως νέες θεραπείες».
Η έγκριση του fedratinib από την Ευρωπαϊκή Επιτροπή βασίστηκε σε αποτελέσματα από τις μελέτες JAKARTA και JAKARTA2, οι οποίες συμπεριέλαβαν ασθενείς από 14 χώρες της Ευρωπαϊκής Ένωσης.
Η πιλοτική μελέτη JAKARTA αξιολόγησε την αποτελεσματικότητα δόσεων του fedratinib, χορηγούμενων από του στόματος άπαξ ημερησίως σε σύγκριση με εικονικό φάρμακο, σε 289 ασθενείς με ενδιάμεσου-2 ή υψηλού κινδύνου πρωτοπαθή ή δευτεροπαθή μυελοΐνωση με σπληνομεγαλία.
Η μελέτη JAKARTA 2 αξιολόγησε την αποτελεσματικότητα δόσεων του fedratinibσε 97 ασθενείς με ενδιάμεσου ή υψηλού κινδύνου πρωτοπαθή ή δευτεροπαθή μυελοΐνωση με σπληνομεγαλία, οι οποίοι είχαν λάβει προηγούμενη θεραπεία με ruxolitinib.
Στο πρόγραμμα κλινικής ανάπτυξης του fedratinib, το οποίο περιλάμβανε 608 ασθενείς, παρατηρήθηκαν σοβαρά περιστατικά εγκεφαλοπάθειας, συμπεριλαμβανομένης της εγκεφαλοπάθειας Wernicke, στους ασθενείς που έλαβαν θεραπεία με fedratinib.
Σοβαρά περιστατικά αναφέρθηκαν στο 1,3% (8/608) των ασθενών που έλαβαν fedratinib στο πλαίσιο κλινικών μελετών και το 0,16% (1/608) των περιστατικών ήταν θανατηφόρα.
«Με τη σημερινή έγκριση του fedratinib από την Ευρωπαϊκή Επιτροπή, οι ασθενείς μεμυελοΐνωση σε ολόκληρη την Ευρώπη θα έχουν πλέον στη διάθεσή τους μια κρίσιμης σημασίας νέα επιλογή για μια σπάνια διαταραχή του μυελού των οστών, πεδίο όπου έχει σημειωθεί ελάχιστη πρόοδος τα τελευταία χρόνια», δήλωσε η Diane Mc Dowell, M.D., αντιπρόεδρος του Τμήματος Παγκόσμιων Ιατρικών Υποθέσεων στον τομέα της Αιματολογίας της Bristol Myers Squibb.

«Έχουμε δεσμευτεί να βελτιώνουμε τα πρότυπα φροντίδας για τους ασθενείς που ζουν με δύσκολα αντιμετωπίσιμες αιματολογικές παθήσεις και συνεργαζόμαστε με τα κράτη μέλη της Ευρωπαϊκής Ένωσης ώστε να καταστήσουμε το fedratinib διαθέσιμο στους ασθενείς το ταχύτερο δυνατόν».
*Η κεντρική Άδεια Κυκλοφορίας δεν περιλαμβάνει την έγκριση για χρήση στη Μεγάλη Βρετανία (Αγγλία, Σκωτία και Ουαλία).
Σχετικά με τις μελέτες JAKARTAκαι JAKARTA2
Το πρόγραμμα ανάπτυξης του fedratinib περιελάμβανε πολλές μελέτες (συμπεριλαμβανομένων των μελετών JAKARTA καιJAKARTA2) με τη συμμετοχή 608 ασθενών, οι οποίοι έλαβαν περισσότερες από μία δόσεις (από 30 mgέως 800 mg), εκ των οποίων οι 459 έπασχαν από μυελοΐνωση, συμπεριλαμβανομένων 97 ασθενών οι οποίοι είχαν λάβει προηγούμενη θεραπεία με ruxolitinib.
Η μελέτη JAKARTA ήταν μία πιλοτική, πολυκεντρική, τυχαιοποιημένη, διπλά-τυφλή, ελεγχόμενη με εικονικό φάρμακο μελέτη Φάσης 3 που αξιολόγησε την αποτελεσματικότητα δόσεων του fedratinib, χορηγούμενων από του στόματος άπαξ ημερησίως, σε σύγκριση με εικονικό φάρμακο σε ασθενείς με ενδιάμεσου-2 ή υψηλού κινδύνου πρωτοπαθή ή δευτεροπαθή (κατόπιν αληθούς πολυκυτταραιμίας ή κατόπιν ιδιοπαθούς θρομβοκυττάρωσης) μυελοΐνωση με σπληνομεγαλία και αριθμό αιμοπεταλίων ≥50 x 109/L,οι οποίοι δεν είχαν λάβει προηγούμενη θεραπεία με αναστολέαJAK. Η μελέτη συμπεριέλαβε 289 ασθενείς που τυχαιοποιήθηκαν για να λάβουν fedratinibή 500 mg (n=97) ή 400 mg (n=96) ή εικονικό φάρμακο (n=96) σε 94 κέντρα σε 24 χώρες.
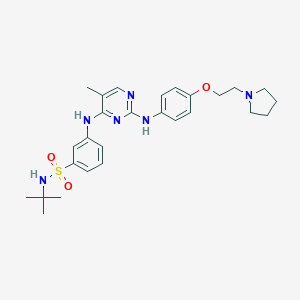
Η μελέτη JAKARTA2 ήταν μία ανοικτή μελέτη μονού σκέλους Φάσης 2 του fedratinibσε ασθενείς μεμυελοΐνωση που είχαν λάβει προηγούμενη θεραπεία μεruxolitinibμε διάγνωσηενδιάμεσου-1 κινδύνου με συμπτώματα, με ενδιάμεσου-2 ή υψηλού κινδύνου μυελοΐνωση, με μυελοΐνωση κατόπιν αληθούς πολυκυτταραιμίας ή μυελοΐνωση κατόπιν ιδιοπαθούς θρομβοκυττάρωσηςμε σπληνομεγαλία και αριθμό αιμοπεταλίων ≥50 x 109/L. Η μελέτη συμπεριέλαβε 97 ασθενείς που ξεκίνησαν να λαμβάνουν θεραπεία με fedratinib 400 mg, χορηγούμενου άπαξ ημερησίως, σε 10 χώρες.
Το πρωτεύον καταληκτικό σημείο των μελετών JAKARTA και JAKARTA2 ήταν το ποσοστό ανταπόκρισης του σπλήνα, που ορίστηκε ως το ποσοστό των ασθενών που πέτυχαν μείωση του όγκου του σπλήνα υψηλότερη ή ίση με 35% από την έναρξη της μελέτης στο τέλος του κύκλου 6, όπως αξιολογήθηκε με μαγνητική τομογραφία (MRI) ή αξονική τομογραφία (CT) με επαναληπτική απεικόνιση ύστερα από 4 εβδομάδες στο πλαίσιο της μελέτης JAKARTA.
Τα δευτερεύοντα καταληκτικά σημεία των μελετών ήταν το ποσοστό ανταπόκρισης των συμπτωμάτων, που ορίστηκε ως το ποσοστό των ασθενών οι οποίοι παρουσίασαν μείωση 50% ή υψηλότερη στην ολική βαθμολογία των συμπτωμάτων από την έναρξη της μελέτης έως το τέλος του κύκλου 6, όπως μετρήθηκε με βάση το ημερολόγιο του τροποποιημένου Εντύπου Αξιολόγησης Συμπτωμάτων Μυελοΐνωσης (MFSAF) v2.0 (νυχτερινή εφίδρωση, κνησμός, κοιλιακή δυσφορία, πρώιμος κορεσμός, πόνος κάτω από τα πλευρά αριστερά, οστικός ή μυικός πόνος).
Ανεπιθύμητες ενέργειες
Οι πιο συχνές ανεπιθύμητες ενέργειες για θεραπεία με fedratinib έναντι εικονικού φαρμάκου ήταν:
-διάρροια (66% έναντι 16%),
-ναυτία (62% έναντι 15%), αναιμία (40% έναντι 14%) κα,
-ι έμετος (39% έναντι 5%).
Διακοπές δοσολογίας λόγω ανεπιθύμητης ενέργειας κατά τη διάρκεια της τυχαιοποιημένης περιόδου θεραπείας εμφανίστηκαν στο 21% των ασθενών που έλαβαν fedratinib.
Οι ανεπιθύμητες ενέργειες που απαιτούσαν διακοπή της δοσολογίας σε> 3% των ασθενών που έλαβαν fedratinib περιελάμβαναν διάρροια και ναυτία.
Μειώσεις δοσολογίας λόγω ανεπιθύμητης ενέργειας κατά τη διάρκεια της τυχαιοποιημένης περιόδου θεραπείας εμφανίστηκαν στο 19% των ασθενών που έλαβαν fedratinib.
Οι ανεπιθύμητες ενέργειες που απαιτoύσαν μείωση της δοσολογίας σε> 2% των ασθενών που έλαβαν fedratinib περιελάμβαναν αναιμία (6%), διάρροια (3%), έμετο (3%) και θρομβοπενία (2%).
Σχετικά με τη μυελοΐνωση
Η μυελοΐνωση είναι μία σοβαρή και σπάνια διαταραχή του μυελού των οστών που διαταράσσει τη φυσιολογική παραγωγή των κυττάρων του αίματος.
Ο μυελός των οστών σταδιακά αντικαθίσταται από ινώδη ουλώδη ιστό, που περιορίζει την ικανότητα του μυελού των οστών να παράγει κύτταρα του αίματος.
Η διαταραχή μπορεί να οδηγήσει σε αναιμία, εξασθένηση, κόπωση, διόγκωση του σπλήνα και του ήπατος και άλλα συμπτώματα.
Η μυελοΐνωση ανήκει στην κατηγορία των μυελοϋπερπλαστικών νεοπλασιών, μία ομάδα σπάνιων αιματολογικών κακοηθειών που οφείλονται σε αιμοποιητικά βλαστικά κύτταρα. Στην Ευρωπαϊκή Ένωση, σχεδόν 1 στους 100.000 ανθρώπους θα διαγιγνώσκεται με μυελοΐνωση κάθε χρόνο.
Επηρεάζει εξίσου τους άνδρες και τις γυναίκες και ενώ η νόσος είναι δυνατόν να προσβάλει άτομα όλων των ηλικιών, η διάμεση ηλικία διάγνωσης κυμαίνεται μεταξύ 60 και 67 ετών.
Η διάμεση επιβίωση μετά τη διακοπή της θεραπείας με ruxolitinib είναι γενικά χαμηλή, καθώς κυμαίνεται μεταξύ 6 μηνών και 2 ετών, γεγονός που αντικατοπτρίζει τη σημαντική ανάγκη για εναλλακτικές θεραπευτικές επιλογές.