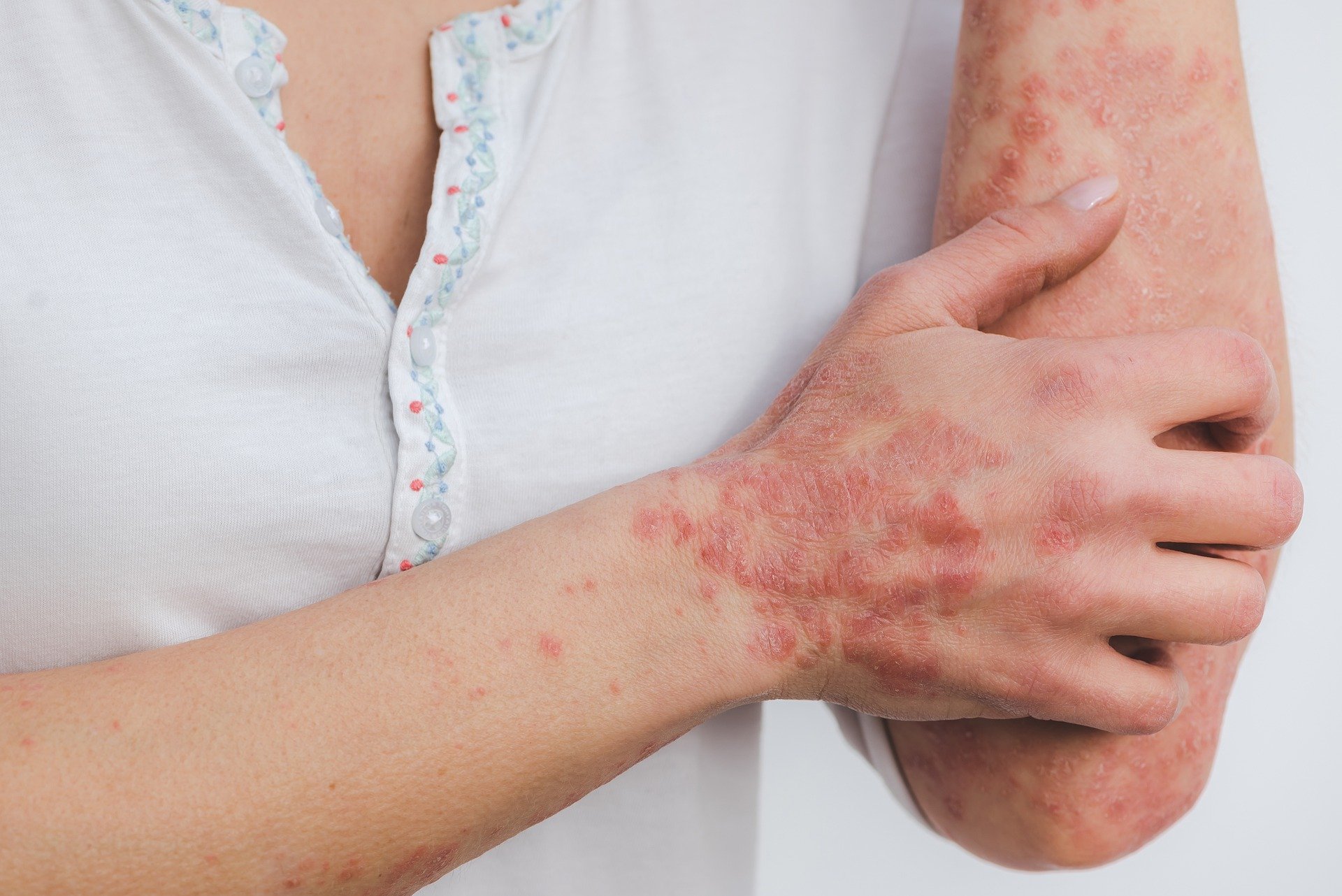
Νέα δεδομένα έρχονται στο φως για την αποτελεσματικότητα, την ανεκτικότητα και την ασφάλεια της μπιμεκιζουμάμπης (BIMZELX®) που χορηγείται σε ασθενείς με μέτρια ως σοβαρή Ψωρίαση κατά Πλάκας.
Τα ενδιάμεσα αποτελέσματα της μελέτης BE BRIGHT, που διεξήχθη για διάστημα 2 ετών σε ενήλικους ασθενείς, που είχαν ολοκληρώσει μια εκ των τριών εγκριτικών μελετών Φάσης 3, μαζί με νέα ευρήματα από το κλινικό πρόγραμμα Φάσης 3/3b για τη μπιμεκιζουμάμπη στην Ψωρίαση ανακοινώθηκαν από τη UCB στο 30ο Συνέδριο της Ευρωπαϊκής Ακαδημίας Δερματολογίας και Αφροδισιολογίας (EADV).
Τα ενδιάμεσα αποτελέσματα της μελέτης BE BRIGHT που παρουσιάστηκαν στο EADV έδειξαν ότι οι ασθενείς που έλαβαν μπιμεκιζουμάμπη πέτυχαν διατηρήσιμα αποτελέσματα καθαρότητας δέρματος ( PASI 90 PASI 100) για 2 χρόνια με δόση συντήρησης*.
Παράλληλα, αποδείχθηκε ότι η μπιμεκιζουμάμπη ήταν γενικώς καλά ανεκτή, χωρίς νέα σήματα ασφαλείας.
Η μετάβαση στη μπιμεκιζουμάμπη μετά από 24 εβδομάδες χορήγησης ανταλιμουμάμπης στη BE SURE, οδήγησε σε διατηρήσιμη αύξηση των ποσοστών ανταπόκρισης PASI 90 και PASI 100 για διάστημα 2 ετών.
Επιπλέον, η μετάβαση σε μπιμεκιζουμάμπη μετά από 52 εβδομάδες θεραπείας με ουστεκινουμάμπη (BE VIVID) οδήγησε σε διατηρήσιμη αύξηση των ποσοστών ανταπόκρισης PASI 100 έως την 100η εβδομάδα.
Οι ασθενείς που μεταπήδησαν σε μπιμεκιζουμάμπη μετά από ανεπαρκή ανταπόκριση στην ουστεκινουμάμπη την 52η εβδομάδα, έδειξαν επίσης διατηρήσιμη βελτίωση στα επίπεδα της κάθαρσης του δέρματος (PASI 90 και PASI 100).
«Μετά την πρόσφατη έγκριση της μπιμεκιζουμάμπης στην Ευρώπη, είμαστε στην ευχάριστη θέση να μοιραστούμε τα νέα δεδομένα θεραπείας δύο ετών στο EADV, που υποστηρίζουν την κλινική αξία της μπιμεκιζουμάμπης στη μέτρια έως σοβαρή ψωρίαση.
Το εύρος των μακροχρόνιων δεδομένων αποτελεσματικότητας και ασφάλειας που παρουσιάζονται προσφέρουν σημαντικές νέες πληροφορίες για την δερματολογική κοινότητα και αντικατοπτρίζουν τη δέσμευσή μας για βελτίωση της περίθαλψης για άτομα με ψωρίαση», ανέφερε ο Emmanuel Caeymaex, Εκτελεστικός Αντιπρόεδρος Ανοσολογίας και επικεφαλής ΗΠΑ της UCB.
«Στην κλινική πρακτική, οι ασθενείς με μέτρια έως σοβαρή ψωρίαση κατά πλάκας μπορεί να χρειαστεί να μεταβούν μεταξύ βιολογικών φαρμάκων για τον βέλτιστο έλεγχο της νόσου τους.
Μακροχρόνια αποτελέσματα από τη μελέτη BE SURE και τη μελέτη ανοιχτής επέκτασης BE BRIGHT που ανακοινώθηκαν στο EADV 2021 έδειξαν ότι η μετάβαση από την ανταλιμουμάμπη σε μπιμεκιζουμάμπη, βοήθησε περισσότερους ασθενείς με μέτρια έως σοβαρή ψωρίαση να επιτύχουν και να διατηρήσουν εντελώς καθαρό δέρμα, όπως μετρήθηκε με το δείκτη PASI 100, μετά από δύο χρόνια θεραπείας», επεσήμανε ο καθηγητήςDiamant Thaçi, Institute and Comprehensive Center for Inflammation Medicine, University Hospital of Lübeck, Lübeck, Germany.
Μακροχρόνια αποτελέσματα από τις μελέτες BE SURE και την ανοιχτής επέκτασης BE BRIGHT
Αφού τελείωσαν τη μελέτη φάσης 3 BE SURE, οι ασθενείς μπορούσαν να εγγραφούν στη μελέτη ανοιχτής επέκτασης.
Η μετάβαση από ανταλιμουμάμπη σε μπιμεκιζουμάμπη 320mg κάθε 4 εβδομάδες (Q4W), είχε ως αποτέλεσμα διατηρήσιμα ποσοστά ανταπόκρισης κατά PASI 90 και PASI 100 έως και 2 χρόνια ( 104η εβδομάδα), τα οποία ήταν συγκρίσιμα με τα ποσοστά ανταπόκρισης που παρατηρήθηκαν σε ασθενείς που λάμβαναν συνεχώς μπιμεκιζουμάμπη.
Η μπιμεκιζουμάμπη ήταν καλά ανεκτή στη διάρκεια των 2 ετών χωρίς κανένα νέο σήμα ασφάλειας (παρενέργειες)
Δεδομένα 2 ετών σε ασθενείς της μπιμεκιζουμάμπης που μεταπήδησαν από την ουστεκινουμάμπη.
Η ανάλυση αυτή, συμπεριέλαβε ενήλικες ασθενείς από τη BE VIVID που τυχαιοποιήθηκαν αρχικά σε ουστεκινουμάμπη 45 mg ή 90 mg (ανάλογα με το βάρος τους) τις εβδομάδες 0,4 και στη συνέχεια κάθε 12 εβδομάδες ή σε μπιμεκιζουμάμπη 320 mg κάθε 4 εβδομάδες έως την εβδομάδα 52.
Ανάλογα με την ανταπόκριση κατά PASI 90 την εβδομάδα 52, οι ασθενείς που εισήχθησαν στη μελέτη ανοιχτής επέκτασης επανατυχαιοποιηθήκαν σε μπιμεκιζουμάμπη 320 mg κάθε 4 εβδομάδες ή κάθε 8 εβδομάδες.
Δεν παρατηρήθηκαν μη αναμενόμενα ευρήματα ασφάλειας σε ασθενείς που μεταπήδησαν από ουστεκινουμάμπη σε μπιμεκιζουμάμπη κατά τη διάρκεια της μελέτης ανοιχτής επέκτασης.
Η μπιμεκιζουμάμπη είναι ο πρώτος εκλεκτικός αναστολέας της IL-17A και IL -17F που εγκρίθηκε στην Ευρωπαϊκή Ένωση για τη θεραπεία της μέτριας ως σοβαρής Ψωρίασης κατά πλάκας σε ενήλικους ασθενείς που είναι υποψήφιοι για συστηματική θεραπεία.
* Η συνιστώμενη δόση τη μπιμεκιζουμάμπης για ενήλικες ασθενείς με ψωρίαση κατά πλάκας είναι 320 mg (χορηγείται ως δύο υποδόριες ενέσεις των 160 mg) την εβδομάδα 0, 4, 8, 12, 16 και στη συνέχεια κάθε οκτώ εβδομάδες.
Σε κάποιους ασθενείς με σωματικό βάρος ≥ 120 kg που δεν πετυχαίνουν πλήρη κάθαρση δέρματος τη 16η εβδομάδα, η δοσολογία των 320 mg κάθε τέσσερις εβδομάδες μετά την εβδομάδα 16 μπορεί να βελτιώσει περαιτέρω την ανταπόκριση στη θεραπεία.
Στις μελέτες που παρουσιάστηκαν στο EADV 2021, οι ασθενείς έλαβαν δόση συντήρησης μπιμεκιζουμάμπης κάθε 4 ή κάθε 8 εβδομάδες.